Per cominciare a conoscere
Per la messa a punto di nuove terapie per il tumore dell’ovaio è necessario avere buoni modelli preclinici per due motivi:
- i modelli ci possono permettere di capire le cause della patologia o quantomeno chiarire i meccanismi alla base della trasformazione della cellula normale in cellula tumorale;
- i modelli sono di fondamentale importanza per testare nuove terapie che possono poi essere traslate in clinica.
I modelli preclinici più utilizzati sono:
modelli in vitro, cioè le colture cellulari. Questi sono più convenienti, meno dispendiosi, più facili da maneggiare e non coinvolgono animali da esperimento. Le linee cellulari tenute in coltura in vitro per tanto tempo sono molto diverse dalle cellule da cui hanno preso origine, perché mantenute in condizioni selettive. Tuttavia, anche se sono di estrema importanza per studiare i meccanismi responsabili della trasformazione tumorale, questi modelli non riproducono la complessità e l’eterogeneità del tumore nel suo insieme, ed è per questo che si rendono necessari modelli in vivo negli animali. Recentemente sono state messe a punto delle condizioni sperimentali che hanno permesso l’isolamento e la crescita di organoidi da tessuto tumorale ovarico, sia di provenienza da paziente ma anche da tumori cresciuti nell’animale. Gli organoidi sono strutture che crescono in maniera tridimensionale e dovrebbero meglio rappresentare il tumore perché teoricamente costituiti da tutte le cellule che lo compongono (i.e. cellule tumorali, cellule del microambiente tumorale e possibilmente anche cellule del sistema immunitario). Questi organoidi si presuppone possano costituire un modello ponte tra linee cellulari in vitro e modelli animali e vengono a oggi molto utilizzati sia per meglio caratterizzare la biologia del carcinoma dell’ovaio sia come piattaforma per testare nuovi farmaci e/o combinazioni di farmaci.
modelli in vivo, che comprendono sia modelli singenici (cioè modelli di tumore murino trapiantati in topi immuno-competenti) sia modelli di xenotrapianto (dal greco xeno – “esterno”) con cui si intende il trapianto di cellule, tessuti o organi tra esseri viventi di diversa specie (in genere tumori umani trapiantati in topi immunodeficienti).
Per continuare a conoscere
I modelli in vivo
I modelli singeneici
I modelli xenograft
A cosa servono i modelli xenograft
Dai modelli alla pratica clinica
I modelli in vivo
Avere a disposizione dei modelli in vivo di tumore ovarico è di estrema importanza perché con questi modelli è possibile rispondere a specifiche domande a cui i modelli in vitro non sono in grado di rispondere, come per esempio testare l’efficacia antitumorale di un composto nuovo e di una nuova combinazione, o ancora l’eventuale tossicità o le interazioni tra ospite e tumore.
I modelli singeneici
I topi generalmente non sviluppano spontaneamente tumore dell’ovaio. Sono stati però creati dei topi geneticamente modificati in alcuni geni chiave per lo sviluppo di tumore dell’ovaio, che hanno portato allo sviluppo dello stesso. I tumori dell’ovaio cresciuti spontaneamente in questi animali geneticamente modificati sono stati ritrapiantati e stabilizzati in altri topi. Questi modelli murini sono di estrema importanza per lo studio di nuove combinazioni terapeutiche tra farmaci citotossici classici e immunoterapia. I modelli singenici sono di estrema importanza per lo studio della relazione tra cellula tumorale e ospite e in particolare l’interazione tra la cellula tumorale e il microambiente tumorale, e tra la cellula tumorale e il sistema immunitario. Questo è particolarmente importante quando si vogliono chiarire i meccanismi alla base dell’efficacia della immunoterapia.
I modelli xenograft
Questa tecnica di ricerca è stata, ed è, ampiamente utilizzata in campo oncologico. È infatti dalla metà degli anni ‘60 che la messa a punto di modelli animali utili per lo studio di diverse forme di cancro è stata studiata grazie a modelli xenograft.
Questi modelli tumorali sono ottenuti trapiantando cellule tumorali umane, coltivate in vitro o biopsie di tumore ottenute da pazienti, in topi immuno-deficienti (questi ultimi modelli chiamati PDXs, dall’inglese patient-derived xenografts). Questi topi sono caratterizzati dalla mancanza di un efficiente sistema immunitario – sistema in grado di rigettare un organo/tessuto perché non riconosciuto appartenere al proprio organismo – e si prestano a “ricevere” tumori umani che possono così crescere proprio perché gli animali riescono a tollerarli e non li rigettano. A oggi gli animali più utilizzati risultano i topi nudi: animali in cui la rimozione del timo comporta immunodeficienza a livello dei linfociti T nonché perdita totale del pelo, da qui il termine di topi nudi.
A seconda di dove vengono trapiantati i tumori è possibile distinguere due tipi di modelli:
- xenografts ortotopici, quando cioè il tumore viene trapiantato nell’organo da cui prende origine, per esempio cellule tumorali umane ovariche trapiantate nell’ovaio o nel peritoneo, o cellule di tumore del colon trapiantate nel colon dei topi immuno-deficienti;
- xenografts ectopici, cioè quando le cellule tumorali vengono trapiantate generalmente nel sottocute del dorso dei topi. Questa seconda modalità di trapianto è tecnicamente più facile e meno elaborata dei trapianti ortotopici e consente di osservare molto bene la crescita del tumore, dato che il dorso del topo è visibile, consentendo di seguire nel tempo la crescita tumorale.
Nella figura viene spiegato l’isolamento e l’utilizzo di modelli xenograft del tumore dell’ovaio utilizzato nel laboratorio di ricerca.

Occorre sottolineare che non tutti i tumori trapiantati nel topo immuno-deficiente crescono, e quando crescono si hanno dei tempi molto lunghi di osservazione. Per esempio ci sono stati casi in cui il tumore è cresciuto dopo 6 o 9 mesi da quando è stato trapiantato; inoltre, una volta originatosi a volte cresce molto lentamente per cui sono necessari diversi mesi prima che possa essere prelevato e ri-trapiantato in altri topi nudi per effettuare tutti gli studi del caso. Ciononostante è al momento disponibile una piccola banca di circa 50 casi di tumori PDXs (xenobanca), già caratterizzati sotto molto aspetti, che rappresenta una delle più grandi banche disponibili a livello internazionale.
A cosa servono gli xenografts
I modelli xenografts sono stati caratterizzati dai seguenti punti di vista:
istologico: mediante tecniche di immunoistochimica è stato dimostrato che tutti i modelli di PDXs ottenuti riproducono da un punto di vista patologico i tumori umani da cui hanno preso origine. La xenobanca comprende quindi tumori sierosi, che rappresentano circa l’80% dei tumori dell’ovaio, ma anche tumori endometrioidi, mucinosi, a cellule chiare, carcinosarcomatosi e tumori indifferenziati. La maggior parte di questi tumori riproduce fedelmente i tumori da cui hanno preso origine, così come sotto riportato.

molecolare: gli studi molecolari effettuati ci hanno permesso di stabilire che questi PDXs rappresentano i tumori primari da cui hanno preso origine. Inoltre studi più dettagliati sulla presenza di mutazioni chiave del tumore dell’ovaio ci stanno permettendo di correlare la risposta osservata ad alcune classi di farmaci (come cisplatino e inibitori di Poli ADP-ribosio polimerasi – PARP). Questo tipo di studio è di estrema importanza perché potrebbe permettere una giusta stratificazione dei pazienti che potrebbero essere o non essere trattati in base a specifiche caratteristiche molecolari.
farmacologico: la cosa più importante è la possibilità di effettuare degli studi in cui si valuta l’efficacia di agenti chemioterapici come cisplatino e taxolo, farmaci comunemente usati per il trattamento di questo tumore. In questo tipo di esperimenti viene trapiantato un frammento di tumore nel sottocute del dorso di diversi topi nudi. Quando il tumore raggiunge una dimensione visibile e palpabile, gli animali vengono suddivisi in modo casuale (“randomizzati”) in gruppi diversi. Ad esempio, un gruppo “controllo”, che è il gruppo di animali che non viene trattato, un gruppo “trattato” con il cisplatino e un altro un gruppo “trattato” con taxolo. La crescita del tumore viene quindi seguita nel tempo permettendo di ottenere delle curve di crescita del tumore non trattato e delle curve di crescita del tumore trattato con farmaci. Dalla elaborazione di questi dati è possibile quantificare l’effetto del trattamento chemioterapico riuscendo a dire che il trattamento è stato:
- i) efficace perché ha rallentato la crescita tumorale;
ii) molto attivo perché ha causato delle regressioni delle dimensioni del tumore;
iii) poco attivo perché nonostante il trattamento, il tumore ha continuato a crescere come nei topi non trattati con nessun farmaco.
A titolo esemplificativo, nella figura sotto riportata è riprodotto un grafico con la crescita di un tumore trattato e non con diversi farmaci: come si può vedere in questo caso il taxolo è stato poco attivo, mentre il trattamento con cisplatino e trabectedina (Yondelis) è stato molto efficace perché ha causato una regressione del tumore, che è però poi ricresciuto.

Dai modelli alla pratica clinica
Con questi modelli saremo in grado di capire cosa effettivamente fa il trattamento al tumore e avendo a disposizione molti modelli potremmo cercare di capire perché alcuni tumori rispondono e altri no al trattamento con cisplatino. Questo è infatti un problema di rilevanza clinica notevole dato che è noto come tumori responsivi al trattamento con cisplatino diventano poi resistenti allo stesso. Modelli di PDXs recentemente isolati in laboratorio riproducono proprio questa situazione clinica. Infatti, modelli sensibili di PDX sono stati sottoposti a più cicli di platino e successivamente testati per la risposta alla terapia, e mostravano di aver acquisito la resistenza, come schematizzato nella figura.

Questi modelli rappresentano un’importante risorsa per lo studio dei meccanismi alla base dello sviluppo della resistenza alla chemioterapia; in laboratorio sono in corso diverse analisi per comprendere meglio questo fenomeno e cercare di sviluppare nuove terapie in grado di contrastarlo. Allo stesso modo sono stati ottenuti, e sono in continuo isolamento, dei modelli che riproducono lo sviluppo della resistenza ai PARP inibitori. Questo permetterà di studiare i meccanismi molecolari alla base della resistenza a questa classe di farmaci al fine di sviluppare nuove strategie terapeutiche che possano far fronte anche a questo bisogno clinico.
Questi modelli di carcinoma ovarico resi resistenti dopo trattamento in vivo nell’animale mimano molto bene la situazione clinica del paziente e si sono già rilevati di importanza nel definire i meccanismi che portano all’insorgenza della resistenza e quindi trovare delle modalità per antagonizzare o rallentare l’insorgenza della stessa. Inoltre saranno di estrema importanza per trovare nuove combinazioni terapeutiche attive di farmaci attive in tumori resistenti.
Eterogeneità tumorale
Nell’ultimo decennio i tumori sono stati sempre più riconosciuti come organi la cui complessità si avvicina e può persino superare quella dei tessuti sani. Vista da questa prospettiva, la biologia di un tumore può essere compresa appieno solo studiando i singoli tipi di cellule al suo interno. Il tumore risulta quindi un tessuto altamente eterogeneo, composto di diversi tipi cellulari tumorali (es. cellule staminali tumorali, cellule tumorali differenziate) e di un microambiente in cui diverse popolazioni extratumorali contribuiscono alla crescita del tumore stesso (vedasi figura).
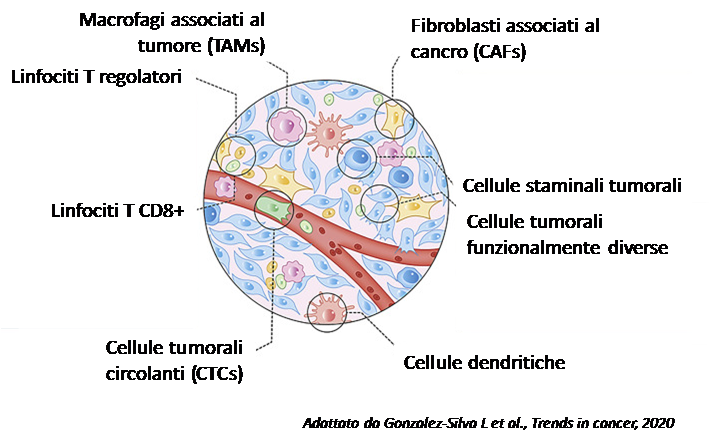
Alla complessità dell’eterogeneità tumorale si aggiunge la capacità delle cellule tumorali che presentano uno stesso genotipo di riuscire ad acquisire e a transitare tra genotipi e fenotipi diversi in risposta ad un microambiente tumorale (Tumor MicroEnvironment – TME) avverso e a diverse condizioni come ipossia, infiammazione e l’esposizione a una terapia farmacologica. Questa caratteristica è nota come plasticità cellulare, e contribuisce all’eterogeneità del tumore, alla sua evoluzione e può promuovere l’insorgenza della resistenza alla terapia come anche lo sviluppo di metastasi. La comprensione dell’eterogeneità tumorale risulta fondamentale, e non solo fornisce approfondimenti sullo sviluppo e sulla progressione del tumore, ma diventa molto importante per la progettazione di terapie personalizzate. L’eterogeneità del tumore può anche infatti riflettersi in una eterogeneità nella risposta al trattamento. L’eterogeneità della risposta a un farmaco può essere infatti dovuta alla presenza di diversi cloni cellulari (cloni molto sensibili, sensibili e resistenti) nel tumore, e questi potrebbero evolversi con il trattamento ed essere infine responsabili della resistenza alla terapia (vedasi figura).

In questo contesto, le indagini molecolari effettuate su un tumore in toto non sono in grado distinguere i diversi componenti cellulari all’interno del tumore, ma i recenti progressi nello sviluppo delle tecnologie molecolari a livello di singola cellula hanno fornito una soluzione senza precedenti per superare questo limite. Mediante tecniche di sequenziamento a singola cellula è possibile avere il profilo dei transcittomi, genomi, proteomi ed epigenomi dei diversi componenti cellulari all’interno del tumore, insieme alla loro distribuzione spaziale tramite tecniche di imaging di altissimo livello.
I modelli di PDXs di cancro ovarico ottenuti nel nostro laboratorio, come già detto, ben riproducono l’eterogeneità tumorale, e vengono utilizzati per comprendere i meccanismi alla base delle diverse risposte alla terapia. Indagini di sequenziamento dell’RNA a singola cellula (scRNAseq) su modelli tumorali non trattati e trattati con chemioterapia a diversi stadi della risposta al trattamento (stadio di “miglior risposta”, o di recidiva) permetteranno di identificare e raggruppare popolazioni cellulari tumorali e del microambiente tumorale, analizzare l’interazione tra le diverse sottopopolazioni, e di capire come si evolvono i diversi sottocloni durante la progressione del tumore e durante il trattamento. Questi risultati saranno fondamentali per capire come contrastare l’insorgenza della resistenza e per lo sviluppo di nuove strategie terapeutiche.
A cura di
Giovanna Damia e Francesca Ricci
Unità di Riparazione del DNA
Laboratorio di Farmacologia Molecolare
Dipartimento di Oncologia
Istituto di Ricerche Farmacologiche Mario Negri IRCCS
Aggiornamento Giugno 2023
